|
L'électrodialyse
I.
L'électrodialyse : présentation.
L'électrodialyse
est un procédé électrochimique qui permet d'extraire les ions contenus dans une
solution grâce au passage d'un courant électrique, elle a
donc pour but de faire diminuer la concentration d'une
solution.
Expliquons
tout d'abord ce qu'est un ion : un ion est un atome (ce qui
constitue la matière) ou une molécule (groupe d'atomes)
ayant gagné ou perdu un ou plusieurs électrons. Un ion chargé
positivement, qui a donc perdu des électrons, est appelé
cation ; un ion chargé négativement, qui a donc gagné des
électrons, est appelé anion.
L'eau
de mer contient du sel ou chlorure de sodium, de formule Na+
+ Cl-. L'électrodialyse permet donc ici de
retirer les ions sodium Na+ (des cations) et
les ions chlorure Cl- (des anions), d'où la désalinisation
de l'eau.
Pour
ce faire nous utilisons un électrodialyseur, qui fonctionne
de la manière suivante :
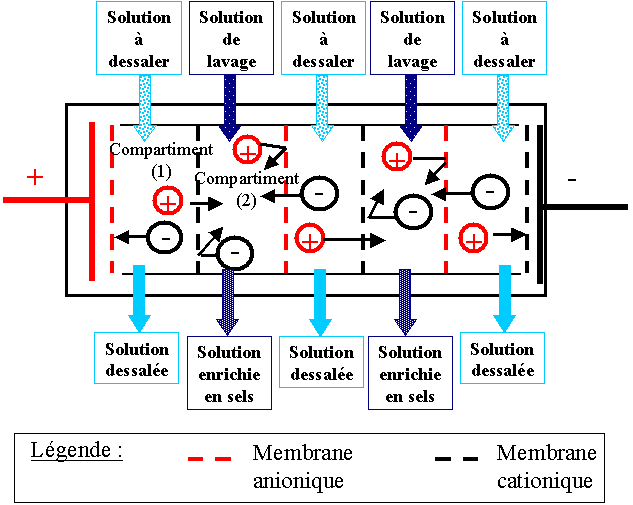
L'eau
salée est introduite dans de nombreux compartiments placés
à la suite les uns des autres et qui sont séparés chacun
par une membrane cationique, qui ne laisse passer que les
cations, et une membrane anionique, qui ne laisse passer que
les anions. Les membranes cationiques et anioniques sont placées
en alternance. Cette suite de compartiments est traversée par
un courant électrique alimenté par un générateur, grâce
à des électrodes placées à chaque extrémité de
l'appareil.
Ainsi
les cations migrent dans le sens du courant électrique (du +
vers le -) en ne traversant que la membrane cationique, car
les cations chargés positivement sont attirés par la borne négative.
Au contraire, les anions, chargés négativement et donc attirés
par la borne positive, ne circulent que dans le sens contraire
à celui du courant en ne traversant que la membrane
anionique.
De
cette façon, certains compartiments appelés compartiments de
dilution (1) seront appauvris en sel dissous, étant donné
que les ions seront de moins en moins nombreux, et d'autres
appelés compartiments de concentration (2) en seront
enrichis, étant donné qu’ils récupèrent les ions des
compartiments de dilution. Comme les membranes, les
compartiments de dilution et de concentration se succèdent en
alternance.
Nous
obtenons donc au final de l’eau dessalée en récupérant
celle issue des compartiments en dilution.
II.
Avantages et inconvénients.
L'avantage
principale de l’électrodialyse est qu'elle est économe en
énergie : il faut 1,8 kWh/m³ pour amener une
solution de concentration de 1,5 à 0,5 g/l, 2,6 à 4 kWh/m³ pour amener une
solution de 2,5 à 0,5 g/l, et enfin 3,2 à 4,5 kWh/m³ pour amener une
solution de 3,5 à 0,5 g/l.
Elle
permet une économie d’apport de matière, tout en limitant
les rejets d’effluents. En effet, les bains de traitement ne
sont plus purgés, ce qui permet d’économiser la quantité
de produits entrant dans les bains.
En
ce qui concerne les inconvénients, le
rendement total de l’électrodialyse peut être abaissé par
des fuites électriques se produisant au niveau de
l’empilement des membranes ou des rampes d’alimentation
des solutions.
Au
cours d’un transfert ionique prolongé au travers des
membranes échangeuses d’ions, des phénomènes abaissant
les performances de l’électrodialyse peuvent se produire
(baisse du rendement, accroissement de la résistance électrique)
et provoquer une altération irréversible des membranes. L'entretien des
membranes est donc assez contraignant.
Enfin,
l'électrodialyse
a un rendement d'environ 45% par passe, il faut donc plusieurs
passes pour un dessalement satisfaisant.
 Retour aux
techniques
Retour aux
techniques
|