|
La distillation
I. La distillation
en général.
La distillation
est une technique qui consiste à séparer, dans un liquide,
les différentes espèces chimiques présentes grâce à leur
température d'ébullition différente.
Placées à une
température T° donnée, seules les espèces de la solution
dont la température d'ébullition est inférieure ou égale à
T° s'évaporeront, laissant derrière elles les autres
espèces dont la température d'ébullition est supérieure à
T°. Les espèces passées à l'état gazeux sont ensuite
refroidies par l'intermédiaire d'un réfrigérant pour revenir à l'état liquide
et ainsi être
recueillies. Nous avons alors séparé les espèces chimiques
de la solution initiale.

En ce qui nous
concerne, notre but est de séparer l'eau du sel. Pour ce
faire, la solution est placée à une température autour de
100°C (température d'ébullition de l'eau) pour que seule
l'eau puisse s'évaporer, laissant le sel et toutes les autres
espèces dans la solution.
Les vapeurs d'eau
sont ensuite liquéfiées dans un système réfrigérant.
Revenue à l'état liquide, cette eau peut alors être
recueillie à la sortie du système réfrigérant.
L'eau obtenue est
en théorie parfaitement pure, étant donné que seules les
molécules d'eau sont censées quitter la solution initiale,
mais en réalité, il y a toujours quelques autres espèces
qui ont été emportées avec l'eau. Néanmoins, l'eau
obtenue possède une pureté tout à fait satisfaisante et
même excellente.
Par
ailleurs, la distillation est le procédé de dessalement le
plus ancien, à titre d'exemple, les marins grecs
l'utilisaient déjà au IIIème siècle avant J.-C. sur leurs
bateaux.
II.
Les autres techniques de distillation.
La
distillation telle qu'elle est présentée ci-dessus possède
un coût très élevé et une efficacité limitée, c'est
pourquoi à l'échelle industrielle nous utilisons quelques
variantes de la distillation que nous allons vous présenter
brièvement :
-
la distillation multiflash : l'eau
est chauffée, puis pompée dans des réservoirs à faible
pression où elle se vaporise brutalement, c'est cette
vaporisation brutale qui est appelée "flash". Après
plusieurs flashs successifs, la vapeur liquéfiée est récupérée,
fournissant de l’eau dessalée.
L'avantage
de cette technique est sa rapidité et son efficacité, mais
son inconvénient majeur reste une grande consommation
d'énergie (≈ 15 kWh/m³).
Néanmoins, cette technique de dessalement est à ce jour la
plus répendue.
-
la distillation à multiples effets : pour cette technique,
des évaporateurs, appelés effets, sont placés en série et
forment le distillateur. Cette technique est caractérisée
par une utilisation
en boucle de la chaleur qui accompagne les vapeurs d'eau. En
effet, les vapeurs chauffées du premier effet servent à
évaporer l'eau contenue dans le second, puis les vapeurs
chauffées issues du second effet servent à évaporer l'eau du
troisième, et ainsi de suite. La vapeur du dernier effet sert
à réchauffer l’eau d’alimentation du premier effet. Cependant
les vapeurs ne pourront pas être éternellement
recyclées du fait des pertes calorifiques, le nombre d'effets
est donc limité. Son avantage majeur est un coût
énergétique faible (≈
10
kWh/m³), et ses inconvénients sont la fragilité et
l'entretien difficile du matériel.
-
la compression mécanique de vapeurs : comme pour la technique
précédente, les vapeurs sont utilisées comme source de
chaleur. Ces vapeurs sont compressées puis injectées dans
l'eau à dessaler, faisant s'évaporer ce dernier. Les vapeurs
(issues de l'eau de mer) sont ensuite recueillies dans des
tubes placées à l'intérieur de la chambre de distillation
pour s'y condenser et produire de l'eau douce. Le point
positif de cette technique est la très faible consommation
d'énergie (≈
5
kWh/m³), mais le point négatif est qu'il nécessite des
investissements importants, notamment dans le matériel
nécessaire.
III.
Notre propre expérience :
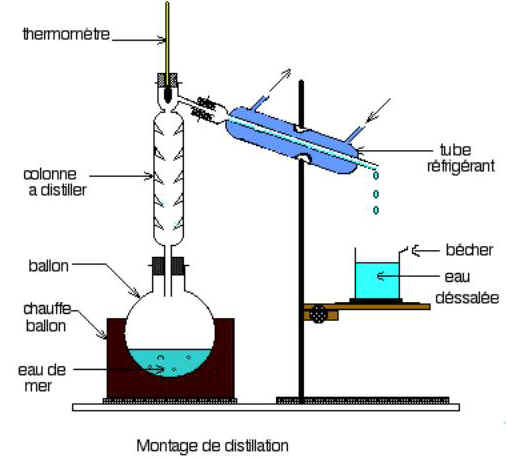
Protocole
de la distillation
Objectif :
dessaler de l’eau de mer en calculant la quantité d’énergie
nécessaire à la production de 100 ml d’eau dessalée
1)
Fabrication de l’eau de mer
L’eau
de mer a une concentration moyenne de 35g/L.
A
l’aide d’une balance, nous dissolvons du sel pour obtenir
une solution de 250 mL de concentration 35g/L.
2)
Distillation
Nous
versons tout d’abord 100 mL de la solution fabriquée dans
un ballon de 250 mL.
Puis
nous le plaçons dans le montage de la distillation et le faisons
chauffer.
Durant
l’expérience, nous comptons le nombre de tour du compteur
électrique.
Enfin
nous récupérons le distillat.
3)
Interprétation
a)
Consommation d’énergie
Nombre
de tours : 42
Or
un tour correspond à 4Wh soit 14000 joules
En
conclusion, pour produire 100 mL d’eau dessalé à l’aide
de la distillation, il faut 5,9.105J.
Cela
équivaut à 16,8 KWh pour 10 L d’eau dessalée ce qui coûtera
1,35 euros, en sachant qu’un kWh coûte en moyenne 8 centimes d’euro.
b)
Test de flamme
Avant
l'expérience :
Après l'expérience :


Un
clou, trempé dans un tube à essai contenant un peu d'eau
salée, est chauffé au bec bunsen, une flamme orange a été observée donc il y a
bien présence d’ions
sodium (Na+) dans cette eau.
Après
l'expérience, un autre clou, trempé dans un tube à essai contenant un peu de
distillat, est chauffé au bec bunsen, aucun changement de
couleur n'a été observé donc il y a une absence d’ions
sodium (Na+) dans le distillat.
c)
Test du nitrate d’argent
Avant
l'expérience :
Après l'expérience :


Nous
versons un peu de nitrate d’argent dans un tube à
essai contenant un peu d'eau salée et nous observons un précipité blanc
(qui noircit à la lumière) donc il y a bien des ions
chlorure (Cl-).
Après
l'expérience, nous
versons un peu de nitrate d’argent dans un autre tube à
essai contenant un peu de distillat et nous observons une
absence de précipité blanc donc il n’y a pas d’ions
chlorure (Cl-).
d)
Test de conductivité
Avant
l'expérience :
Après l'expérience :


A
l’aide d'un ampèremètre nous mesurons l'intensité du courant
traversant l'eau salée, nous
observons une intensité de 34,3 mA, donc il s'agit bien d'une
solution ionique.
Après
l'expérience, nous mesurons l'intensité du courant
traversant le distillat. Nous
observons une intensité de 0,2 mA.
Nous savons qu’une solution ionique conduit fortement
le courant, or l'intensité relevée est quasiment nul, donc
il y a très peu d'ions dans le distillat.
Conclusion
: le distillat n’est plus une solution de chlorure de
sodium, nous avons donc bien obtenu de l’eau dessalée.
 Retour aux
techniques
Retour aux
techniques
|